Лечебные медицинские пластыри
 Лечебный пластырь относится к фармацевтическим формам, предназначенным для введения фармакологических препаратов в организм человека через кожу. Лечебные пластыри продаются в готовом виде (произведены они на специальных заводах) или изготавливаются по рецептуре, прописанной врачом. Трансдермальные пластыри применяются не только в дерматологии, но и при заболеваниях опорно-двигательного аппарата. Например, широко известен «Вольтарен» в виде пластыря, которые позволяет избавлять человека от боли в спине на срок до 24 часов. При этом полностью исключается вредоносное влияние действующего вещества на слизистые оболочки желудочно-кишечного тракта. В статье описаны технологическая схема производства данной фармакологической продукции. Также приведена простейшая классификация медицинских пластырей по способу применения и назначению.
Лечебный пластырь относится к фармацевтическим формам, предназначенным для введения фармакологических препаратов в организм человека через кожу. Лечебные пластыри продаются в готовом виде (произведены они на специальных заводах) или изготавливаются по рецептуре, прописанной врачом. Трансдермальные пластыри применяются не только в дерматологии, но и при заболеваниях опорно-двигательного аппарата. Например, широко известен «Вольтарен» в виде пластыря, которые позволяет избавлять человека от боли в спине на срок до 24 часов. При этом полностью исключается вредоносное влияние действующего вещества на слизистые оболочки желудочно-кишечного тракта. В статье описаны технологическая схема производства данной фармакологической продукции. Также приведена простейшая классификация медицинских пластырей по способу применения и назначению.
Классификация видов пластырей по медицинскому назначению
Пластыри медицинские — лекарственная форма, содержащая одно или несколько действующих веществ, предназначенная для наружного применения и обладающая способностью прилипать к коже.
Виды медицинских пластырей, содержащие действующее вещество, могут применяться в виде пластичной однородной массы, в которой они распределены (на подложке или без нее), или в виде прокладки с действующим веществом, закрепленной на подложке с липким слоем.
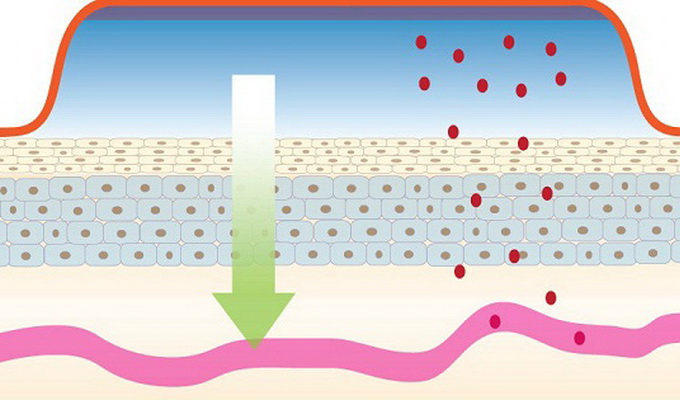
Трансдермальный пластырь — лекарственная форма для наружного применения, предназначенная для контролируемой доставки действующего вещества в системный кровоток путем пассивной диффузии через неповрежденную кожу.
В зависимости от состава пластырной массы различают виды пластырей:
- свинцовые;
- смоляно-восковые (мозольный пластырь);
- каучуковые (лейкопластырь, лейкопластырь бактерицидный, перцовый пластырь, пластырь кровоостанавливающий);
- жидкие (кожные клеи).
Пластыри, не содержащие действующих веществ, в виде липкой ленты используются для фиксации повязок и других целей и не являются лекарственным средством.
В зависимости от носителя различают пластыри на тканевой, нетканой и полимерной основе.
Отдельную группу по классификации медицинских пластырей составляют формы без носителя: жидкие (кожные клеи) и твердые пластырные массы (в виде брусков, цилиндров, плиток, палочек).
По классификации пластырей по медицинскому назначению различают формы, оказывающие действие на кожу, подкожные ткани или обладающие системным действием на организм (трансдермальные пластыри).
Технологическая схема производства пластырей
Технология производства пластырей зависит от того, к какому виду они относятся. Свинцовые пластыри, содержащие в своем составе свинцовое мыло, получают сплавлением свинцовых мыл со смолами, восками, действующими веществами.
По технологической схеме производства пластырей основу смоляно-восковых форм составляют сплавы смол и воска, в состав которых могут входить также жиры и углеводороды.
Каучуковые (илирезиновые пластыри) представляют собой смесь каучука со смолами, действующими и вспомогательными веществами. Данный вид пластырей длительное время сохраняет свою клейкость.
Кожные клеи (или пластыри жидкие) — это вязкие жидкости, оставляющие на коже после испарения легколетучего растворителя эластичную липкую прочную пленку. Пластырная пленка в них образуется за счет пленкообразования при высыхании растворов канифоли, нитроцеллюлозы и перхлорвиниловой и формальдегидной смол в органических растворителях. Для придания пленке большей эластичности в состав клеев вводят растительные масла, линетол, дибутил-фталат, триацетин, цетиловый спирт.
Пластырная масса представляет собой однородную смесь, плотную при комнатной температуре и размягчающуюся, липкую при температуре тела.
Липкий слой на пластырях защищают от контакта с окружающей средой с помощью защитной пленки, удаляемой непосредственно перед применением, или каким-либо другим способом.
В состав пластырной массы могут быть внесены наполнители, антиоксиданты, консерванты, красители, корректоры запаха или другие вспомогательные вещества, разрешенные к медицинскому применению.
Подложка (или гибкий плоский носитель), полученная из синтетических или природных материалов, и липкий слой должны быть гипоаллергенны и не должны оказывать на кожу раздражающего действия.
Пластыри медицинские должны легко удаляться с кожи, не оставляя следов, не нанося повреждений и не отделяя пластырную массу от носителя. Пластыри медицинские, предназначенные для нанесения на раневую поверхность, должны быть стерильными.
Трансдермальный пластырь представляет собой многослойный пластырь. Внешний покровный слой (подложка) является непроницаемым для действующего вещества и служит для придания жесткости всему пластырю, а также для защиты от внешнего воздействия. Со стороны поверхности высвобождения действующего вещества, предназначенной для аппликации на кожу, имеется защитное антиадгезионное покрытие, удаляемое непосредственно перед применением трансдермального пластыря.
Различают два основных вида трансдермальных пластырей: резервуарные и матричные. В резервуарных трансдермальных пластырях действующее вещество находится в запаянном резервуаре в виде раствора, геля, суспензии или эмульсии. Внешний покровный слой резервуара представляет собой непроницаемую для содержимого резервуара полимерную пленку, а внутренний, обращенный к коже слой — полимерную мембрану, регулирующую скорость выхода действующего вещества из резервуара на кожу через слой адгезива. Адгезив обеспечивает прочное крепление пластыря на коже.
В матричных трансдермальных пластырях внешний покровный слой представляет собой непроницаемую для действующего вещества гибкую полимерную пленку, к которой прикреплена полимерная адгезионная матрица, содержащая действующие и вспомогательные вещества.
Площадь внешнего покровного слоя может быть равна площади высвобождения действующего вещества или быть несколько больше, для нанесения по краям пластыря адгезива. Защитное покрытие также может быть несколько больше, чем сам трансдермальный пластырь, что облегчает процесс его удаления.
В качестве вспомогательных веществ могут быть использованы пластификаторы, стабилизаторы, модификаторы скорости высвобождения и усилители проницаемости кожи для действующего вещества, адгезивы, полимеры, сополимеры, растворители, эмульгаторы и другие разрешенные к медицинскому применению вещества, которые не должны обладать местнораздражающим, аллергизирующим и токсическим действием.
Испытания пластырей.
Приводят описание цвета и запаха пластырной массы и ее однородности, материала подложки для нанесения пластырной массы, защитной пленки, форм и размеров пластыря.
Для трансдермального пластыря приводят цвет внешнего покровного слоя, матрицы и/или адгезива с указанием геометрических размеров площади подачи действующего вещества с допустимыми отклонениями.
Для пластырей без подложки проводят испытание массы (объема) содержимого упаковки в соответствии с требованиями ОФС.
Для пластырей с носителем результат количественного определения выражают как содержание действующего вещества в миллиграммах на пластырь, грамм пластырной массы или на грамм прокладок. Для пластырей без носителя результат определения выражают в процентах.
Отклонение содержания действующего вещества в трансдермальном пластыре от заявленного не должно превышать ± 15%.
Свинцовые пластыри дополнительно контролируют по показателям «Посторонние примеси» (пероксид свинца, карбонат свинца и оксид свинца) и «Потеря в массе при высушивании» (должна быть не более 1,0%).
Жидкие пластыри (кожные клеи) дополнительно контролируют по показателям «Растворимость», «pH» — фильтрат должен иметь нейтральную реакцию; «Потеря в массе при высушивании» от 3,8 до 4,2%.
Если указано в ФС или НД, пластыри контролируют по дополнительным показателям «Цинка оксид», «Сопротивление отслаиванию» и др.
Растворение действующего вещества может происходить как в результате непосредственного его высвобождения из шрансдермалъного пластыря в среду растворения (скорость высвобождения), так и в результате подачи действующего вещества в среду растворения через полимерную мембрану (скорость подачи). В ФС или НД указывают: тип прибора; описание держателя; площадь контакта со средой растворения для определения скорости высвобождения действующего вещества или площадь контакта с полимерной мембраной со средой растворения для определения скорости подачи; способ закрепления; применяемая полимерная мембрана; состав и объем среды растворения; скорость вращения мешалки; время отбора проб; аналитический метод количественного определения; нормативные требования. Растворение (скорость высвобождения или скорость подачи) выражают количеством действующего вещества, высвободившегося в единицу времени, с единицы площади трансдермального пластыря.
При использовании в производстве трансдермальных пластырей органических растворителей определяют их предельное содержание согласно ОФС «Остаточные органические растворители».
Для трансдермальных пластырей проводят определение однородности дозирования в соответствии с требованиями ОФС. Если предусмотрено определение однородности дозирования, определение однородности массы не требуется.
Упаковка и хранение пластырей.
Первичной упаковкой для пластырей, включая лейкопластыри, могут быть безъячейковые контурные упаковки различных размеров, а также укупоренные соответствующим образом пачки, пакеты с клапаном, банки из полимерных материалов. Каждый трансдермальный и медицинский пластырь должен быть помещен в индивидуальную первичную упаковку. Каждый пластырь помещают в индивидуальную первичную упаковку, на которой указывают название и содержание действующего вещества (в трансдермальном пластыре — количество подаваемого действующего вещества в единицу времени).
Хранят пластыри в упаковке, обеспечивающей стабильность в течение указанного срока годности лекарственного препарата, в защищенном от света месте при температуре от 8 до 15 °С.





 Расшифровка анализа крови
Расшифровка анализа крови Расшифровка анализа мочи
Расшифровка анализа мочи


 Анатомия человека
Анатомия человека Лекарственные препараты
Лекарственные препараты Нарушения обмена веществ
Нарушения обмена веществ Календарь прививок
Календарь прививок Статьи
Статьи Анализы
Анализы
